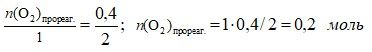Изменения в ЕГЭ по химии в 2022 году
Рассмотрим изменения в ЕГЭ 2022 года по химии, представленных ФИПИ:
-
В экзаменационном варианте общее количество заданий уменьшено с 35 до 34. Это достигнуто в результате объединения контролируемых элементов содержания, имеющих близкую тематическую принадлежность или сходные виды деятельности при их выполнении.
-
Элементы содержания «Химические свойства углеводородов» и «Химические свойства кислородсодержащих органических соединений» (в 2021 г. – задания 13 и 14) будут проверяться заданием 12. В обновлённом задании будет снято ограничение на количество элементов ответа, из которых может состоять полный правильный ответ.
-
Исключено задание 6 (по нумерации 2021 г.), так как умение характеризовать химические свойства простых веществ и оксидов проверяется заданиями 7 и 8.
-
Изменён формат предъявления условий задания 5, проверяющего умение классифицировать неорганические вещества, и задания 21 (в 2021 г. – задание 23), проверяющего умение определять среду водных растворов: в текущем году потребуется не только определить среду раствора, но и расставить вещества в порядке уменьшения/увеличения кислотности среды (рН).
-
Включено задание (23), ориентированное на проверку умения проводить расчёты на основе данных таблицы, отражающих изменения концентрации веществ.
-
Изменён вид расчётов в задании 28: требуется определить значение «выхода продукта реакции» или «массовой доли примеси».
-
Изменена шкала оценивания некоторых заданий в связи с уточнением уровня их сложности и количеством мыслительных операций при их выполнении. В результате этого максимальный балл за выполнение работы в целом составит 56 баллов (в 2021 г. – 58 баллов).
Изменение содержания заданий ЕГЭ-2022 по химии
Единый государственный экзамен (ЕГЭ) является одной из форм государственной итоговой аттестации учащихся и проводится в соответствии с Федеральным законом об образовании Российской федерации. Общее содержание экзаменационной работы соответствует федеральному государственному образовательному стандарту. В 2022 году будут сдавать ЕГЭ учащиеся, которые, начиная с первого класса, обучались в соответствии с ФГОС. По этой причине по всем предметам, в том числе и по химии, происходит изменение содержания экзаменационных материалов; это изменение будет осуществлено в 2022 и 2023 годах.
Общая характеристика работы
Экзаменационная работа состоит из двух частей.
Первая часть содержит 28 заданий с кратким ответом, среди них 20 заданий базового уровня сложности, каждое из которых при правильном выполнении оценивается в 1 первичный тестовый балл (задания 1-5, 9-13, 16-21, 25-28), и 8 заданий повышенного уровня сложности, каждое из которых максимально может быть оценено в 2 балла (задания 6-8, 14, 15, 22-24, 26).
Вторая часть включает 6 заданий с развёрнутым ответом высокого уровня сложности.
Таблица 1
|
Уровень сложности |
Номера заданий |
Максимальный первичный балл / % от максимального первичного балла за работу |
|
1-я часть |
||
| Базовый | 1-5, 9-13, 16-21, 25-28 | 20 / 35,7 |
| Повышенный | 6-8, 14, 15, 22-24, 26 | 16 / 28,6 |
| Всего: | 36 / 64,3 | |
| 2-я часть | ||
| Высокий | 29 | 2 / 3,6 |
| 30 | 2 / 3,6 | |
| 31 | 4 / 7,1 | |
| 32 | 5 / 8,9 | |
| 33 | 4 / 7,1 | |
| 34 | 3 / 5,4 | |
|
Всего: |
20 / 35,7 | |
|
Итого: |
56 |
Распределение заданий и максимальный первичный балл за выполнение задания
В таблице 2 проводится сопоставление формата заданий теста ЕГЭ-2022 по химии по сравнению с 2021 г.
|
Номер вопроса в ЕГЭ-2022 |
Номер вопроса в ЕГЭ-2021 |
Комментарий |
| 1-4 | 1-4 | Совпадение по форме и содержанию |
| 5 | 5 | Новая форма вопроса |
| 6 | 7 | Совпадение |
| 7 | 8 | Совпадение |
| 8 | 9 | Совпадение |
| 9 | 10 | Совпадение |
| 10 | 11 | Совпадение |
| 11 | 12 | Совпадение |
| 12 | 13, 14 | Новая форма вопроса |
| 13 | 15 | Совпадение |
| 14 | 16 | Совпадение |
| 15 | 17 | Совпадение |
| 16 | 18 | Совпадение |
| 17 | 19 | Совпадение |
| 18 | 20 | Совпадение |
| 19 | 21 | Совпадение |
| 20 | 22 | Изменение формы вопроса |
| 21 | - | Новая форма вопроса |
| 22 | 24 | Совпадение |
| 23 | - | Новая форма вопроса |
| 24 | 25 | Совпадение |
| 25 | 26 | Совпадение |
| 26 | 27 | Совпадение |
| 27 | 28 | Совпадение |
| 28 | Новая форма вопроса | |
| 29 | 30 | Совпадение |
| 30 | 31 | Совпадение |
| 31 | 32 | Совпадение |
| 32 | 33 | Совпадение |
| 33 | 34 | Совпадение |
| 34 | 35 | Совпадение |
-
Уменьшилось число вопросов с 35 до 34. Это произошло в результате исключения вопроса 6 (ЕГЭ-2021) и объединения вопросов 13 и 14 в один вопрос и добавления вопроса 23.
-
Уменьшился максимальный первичный балл с 58 до 56. Это произошло в результате исключения вопроса 6 (базовый уровень сложности, уменьшение на 1 балл), объединения вопросов 13 и 14 (базовый уровень сложности, уменьшение на 1 балл), снижения уровня сложности вопросов 20 и 21 с повышенного на базовый (уменьшение на1 балл каждого).
-
Принципиально изменились вопросы 5 (классификация неорганических веществ), 12 (свойства углеводородов и их функциональных производных), 21 (понятие о кислотности среды), 23 (расчёт характеристики химического равновесия с использованием табличной формы представления данных), 28 (расчётная задача базового уровня сложности).
Пособие "Химия. ЕГЭ-2022. Тематический тренинг. Задания базового и повышенного уровней сложности" от издательства Легион разработано с учетом изменений ФИПИ 2022 года.
Примеры новых заданий в егэ по химии 2022 года
Вопрос 5:
Классификация неорганических веществ. Номенклатура неорганических веществ (тривиальная и международная).
Среди предложенных формул веществ, расположенных в пронумерованных ячейках, выберите формулы: А) двухоснóвной кислоты; Б) средней соли; В) амфотерного гидроксида
1
NaH2PO42
Zn(OH)23
HNO24
H2SO35
H3P6
ZnO7
Zn8
NH4NO39
Fe(OH)2
Запишите в таблицу номера ячеек, в которых расположены вещества, под соответствующими буквами.
Гидроксидами называются вещества, которые соответствуют оксидам. Оснóвным оксидам соответствуют оснóвные гидроксиды (основания), амфотерным – амфотерные гидроксиды, кислотным – кислородсодержащие кислоты.
Амфотерным оксидам соответствуют амфотерные гидроксиды. Амфотерные оксиды образуют атомы металлов в степенях окисления +3 или +4; амфотерными являются оксиды ZnO, BeO, Al2O3, Cr2O3, Fe2O3 и оксиды некоторых других металлов.
Zn(OH)2 = ZnO + H2O2Fe(OH)3 = Fe2O3 + 3H2O
Кислотами называются сложные вещества, состоящие из атомов водорода и кислотного остатка. По составу кислотного остатка кислоты классифицируют на кислородсодержащие (H2SO4, HNO3) и бескислородные (HCl, H2S, HCN), по числу атомов водорода — на одноосно́вные (HF, HCl, HCNS) и многоосно́вные (H2CO3, H3PO4).
Солями называются продукты полного или частичного замещения атомов водорода в кислотах на катионы металла или группы NH4+ или, другими словами, соли – электролиты, при диссоциации которых образуются катионы металла (или аммония) и анионы кислотного остатка.
Соли классифицируют на:
а) средние, например: К2SO3 – сульфит калия, CuCl2 – хлорид меди(II);
б) оснóвные, например: CuOHCl – гидроксохлорид меди(II), FeOH(NO3)2 – гидроксонитрат железа(III);
в) кислые, например: NaHSO4 – гидросульфат натрия, Ca(HCO3)2 – гидрокарбонат кальция;
г) комплексные, в состав которых входит сложный катион или анион, состоящий из атома металла-комплексообразователя и лигандов, например: Na[Al(OH)4] – тетрагидроксоалюминат натрия, [Ag(NH3)2]ОН – гидроксид диамминсеребра(I).
Анализ и решение
Необходимо, во-первых, определить класс каждого из предложенных в задании веществ и, во-вторых, правильно записать ответ.
- NaH2PO4 – состоит из атомов натрия и остатка фосфорной кислоты H3PO4, класс солей. В кислотном остатке имеются атомы водорода, следовательно, соль – кислая. Ответ неверный.
- Zn(OH)2 – состоит из атомов цинка (металл) и гидроксильных групп, класс гидроксидов. Гидроксид цинка – амфотерный гидроксид (обязан знать). Ответ В – 2.
- HNO2 – азотистая кислота (обязан знать). Одноосно́вная кислородсодержащая кислота. Ответ неверный.
- H2SO3 – сернистая кислота (обязан знать). Двухосно́вная кислородсодержащая кислота. Ответ А – 4.
- H3P – летучее водородное соединение (фосфин). Ответ неверный.
- ZnO – оксид цинка, амфотерный оксид. Ответ неверный.
- Zn – металл. Ответ неверный.
- NH4NO3 – состоит из групп NH4 и остатка азотной кислоты HNO3. Соль средняя. Ответ Б – 8.
Вывод: правильные ответы найдены. Оставшийся вариант рассматривать не будем.
Ответ: 428.
Вопрос 12:
Характерные химические свойства углеводородов: алканов, циклоалканов, алкенов, диенов, алкинов, ароматических углеводородов (бензола и гомологов бензола, стирола). Основные способы получения углеводородов (в лаборатории). Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола. Характерные химические свойства альдегидов, предельных карбоновых кислот, сложных эфиров. Основные способы получения кислородсодержащих органических соединений (в лаборатории).
Из предложенного перечня выберите все вещества, при взаимодействии которых с раствором перманганата калия в кислой среде образуется карбоновая кислота.
- гексен-1
- бензол
- метилбензол
- этилацетат
- уксусный альдегид
Запишите номера выбранных ответов.
Ответ: _______ .
Анализ и решениеВ кислой среде раствор перманганата калия KMnO4 способен окислять спирты, альдегиды, непредельные углеводороды (алкены, алкины, диены) и их производные, боковые цепи ароматических углеводородов.
Необходимо, во-первых, определить класс каждого из предложенных в задании веществ, во-вторых, проверить возможность протекания реакции и, в третьих, правильно записать ответ.
Необходимо, во-первых, определить класс каждого из предложенных в задании веществ, во-вторых, проверить возможность протекания реакции и, в третьих, правильно записать ответ.
1) Гексен-1 – алкен, должен реагировать с подкислённым раствором перманганата калия с разрывом кратной связи и образованием углекислого газа и валериановой кислоты.
CH3(CH2)3–CH=CH2 + KMnO4 + H2SO4 → CH3(CH2)3–COOH + CO2 + K2SO4 + MnSO4 + H2O
Вывод: ответ 1 – правильный.
2) Бензол. Не окисляется раствором KMnO4.
C6H6 + KMnO4 ≠
Вывод: ответ 2 – неверный.
3) Метилбензол, или толуол, - C6H5–CH3. Возможно окисление группы CH3.
C6H5–CH3 + KMnO4 → C6H5–COOH + K2SO4 + MnSO4 + H2O
Вывод: ответ 3 – правильный.
4) Этилацетат CH3COOC2H5 – сложный эфир. Не должен окисляться раствором KMnO4/
CH3COOC2H5 + KMnO4 ≠
Вывод: ответ неверный.
5) Уксусный альдегид CH3CHO, должен окисляться раствором KMnO4.
CH3CHO + KMnO4 + H2SO4 → CH3COOH + K2SO4 + MnSO4 + H2O
Ответ: 135.
Вопрос 21:
Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная.
Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
- Na2SO4
- Fe(NO3)2
- K2SO3
- НClO3
Запишите номера веществ в порядке возрастания значения pH их водных растворов.
При растворении электролита в воде происходит его взаимодействие с молекулами воды. В результате происходит диссоциация электролита, смещается положение равновесия диссоциации воды и изменяется кислотность среды.
При растворении кислот в результате их диссоциации образуются катионы H+ и среда становится кислой, pH < 7. В растворах сильных кислот концентрация катионов H+ больше, чем в растворах более слабых кислот, и величина pH меньше. Например, в растворах с концентрацией 0,1 моль/л для соляной кислоты pH ≈ 1, для уксусной кислоты рН ≈ 2,9.
При растворении щелочей образуется большое количество гидроксид-ионов OH–, pH > 7.
При диссоциации солей образующие их катионы и анионы будут взаимодействовать с молекулами воды. Гидролизом называется реакция обменного взаимодействия соли и воды, в результате протекания которой смещается положение равновесия диссоциации воды и изменяется кислотность среды. Степень гидролиза, как правило, составляет доли процента и только в отдельных случаях достигает заметных значений. Наиболее выражены процессы гидролиза солей, в состав которых входят катионы слабых оснований и/или анионы слабых кислот. В растворах солей, в состав которых входят катионы слабых оснований, среда кислая, pH < 7. В растворах солей, в состав которых входят анионы слабых кислот, среда щелочная, pH > 7. Чем более слабым является основание или кислота, образующие соль, тем больше будет степень гидролиза и больше изменение кислотности среды и величины pH. Например, для раствора AlCl3 с молярной концентрацией 0,1 моль/л рН ≈ 3,1, раствора NH4Cl ≈ 5.
Вывод:
- необходимо определить классы веществ и возможность протекания гидролиза по формулам веществ;
- в растворах растворимых оснований среда щелочная, в растворах кислот – кислая, причем концентрация катионов H+ в растворах более слабых кислот будет меньше, а величина рН – больше;
- определить относительную силу катионов, взаимодействующих с водой: кислотность среды будет тем больше отклоняться от нейтральной в кислую сторону (следовательно, рН меньше), чем более слабым основанием образована соль;
- определить относительную силу анионов, взаимодействующих с водой: кислотность среды будет тем больше отклоняться от нейтральной в щелочную сторону (следовательно, рН больше), чем более слабой кислотой образована соль;
- для солей, которые образованы сильными основаниями и сильными кислотами условно будем считать среду нейтральной.
- Na2SO4 – сульфат натрия. Средняя соль, образована сильным основанием NaOH и сильной средней кислотой, гидролизу не подвергается. Среда – приблизительно нейтральная
- Fe(NO3)2 – нитрат железа(II). Средняя соль, образован слабым основанием Fe(OH)2 и сильной азотной кислотой HNO3. Гидролиз по катиону Fe2+, среда – кислая.
- K2SO3 – сульфит калия. Средняя соль, образована сильным основанием KOH и кислотой средней силы H2SO3. Гидролиз по кислотному остатку (по аниону), среда – щелочная.
- НClO3 – хлорноватая кислота. Сильная кислота. Среда – кислая.
Понятно, что концентрация катионов H+ будет наибольшей в растворе HClO3, следовательно, pH этого раствора будет иметь наименьшее значение.
Кислотность раствора Fe(NO3)2 будет меньше, чем раствора HClO3, потому что степень гидролиза редко бывает большой.
В растворе K2SO3, имеющем щелочную среду, величина pH будет наибольшей.
Вывод: величина рН будет увеличиться в последовательности
HClO3 < Fe(NO3)2 < Na2SO4 < K2SO3
Ответ: 4213.
Вопрос 23:Обратимые и необратимые химические реакции. Химическое равновесие. Расчёты количества вещества, массы вещества или объёма газов по известному количеству вещества, массе или объёму одного из участвующих в реакции веществ.
В реактор постоянного объёма поместили некоторое количество оксида серы(IV) и кислорода. В результате протекания обратимой реакции в реакционной системе
2SO2(г) + O2(г) ⇄ 2SO3(г)
установилось химическое равновесие.
Используя данные, приведённые в таблице, определите серы (X) и исходную концентрацию кислорода (Y).
Реагент SO2(г) O2(г) SO3(г) Исходная концентрация, моль/л 0,6 Равновесная концентрация, моль/л 0,3 0,4
Выберите из списка номера правильных ответов.


Анализ и решение
Пусть объём системы V = 1 л, тогда изменение концентрации численно равно изменению количества вещества.
1) Вычисляем изменение количества вещества одного из реагентов (SO3):
∆n(SO3) = 0,4 – 0 = 0,4 моль
2) По изменению концентрации SO3 по уравнению реакции вычисляем количество вещества, вступившее в реакцию, других реагентов (SO2 и O2):
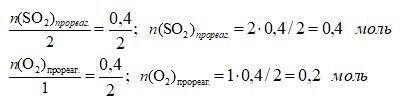
3) Вычисляем количество вещества оксида серы(IV) в состоянии равновесия и исходное количество кислорода:
n(SO2)равн. = 0,6 – 0,4 = 0,2 моль
n(O2)исх. = 0,3 + 0,2 = 0,5 моль
и переносим в таблицу (показаны полужирным шрифтом).
Вывод: X = 0,2 моль/л (2), Y = 0,5 моль/л (5).
Ответ: 25.
Вопрос 28:Расчёты массы вещества или объёма газов по известному количеству вещества, массе или объёму одного из участвующих в реакции веществ. Расчёты массовой или объёмной доли выхода продукта реакции от теоретически возможного. Расчёты массовой доли (массы) химического соединения в смеси.
Из 150 кг природного известняка при взаимодействии с азотной кислотой был получен нитрат кальция массой 196,8 кг. Вычислите массовую долю (%) примесей в указанном известняке. (Запишите число с точностью до целых.)
Ответ: ____ %.
Решение любой расчётной задачи по химии подчиняется достаточно строгому алгоритму.
1) Составить уравнение реакции.
2) Понять главный вопрос задачи.
3) Установить логическую связь: количество какого из веществ необходимо найти, по количеству какого вещества производим расчёт.
4) Произвести расчёты и ответить на главный вопрос задачи.
Решение:
1) Составляем уравнение реакции:
CaCO3 + 2HNO3 = Ca(NO3)2 + H2O + CO2↑
2) Главный вопрос задачи – найти массовую долю примесей в известняке.
Массовая доля вычисляется по формуле
ω = mчасти/mвсего образца
Массовая доля примесей
ω(примеси) = 100% - ω(CaCO3),
Вывод: необходимо найти количество CaCO3, расчёт производим по Ca(NO3)2.
3) Производим расчёт и находим количество и массу CaCO3.
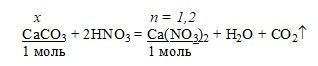
а) находим количество Ca(NO3)2
M(Ca(NO3)2) = 164 г/моль
n(Ca(NO3)2) = m/M = 196,8/164 = 1,2 моль
б) находим количество и массу CaCO3
x = 1∙1,2/1 = 1,2 моль CaCO3
M(CaCO3) = 100 г/моль, m(CaCO3) = 1,2∙100 = 120 г
4) Находим массовую долю примесей.
ω(CaCO3) = 120/150 = 0,8, или 80%
ω(примеси) = 100 – 80% = 20%.
Ответ: 20.